同素异形体
指组成元素相同,分子结构不同的单质。
氧化物
碱性氧化物都是金属氧化物,为什么?
酸性氧化物不都是非金属氧化物。
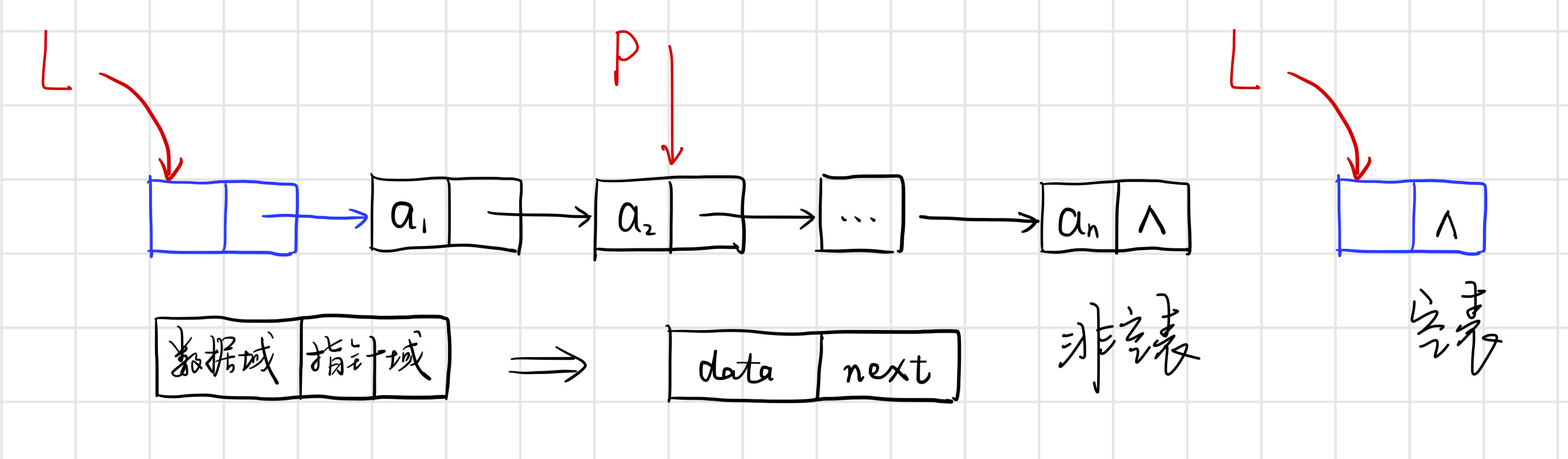
Fe(OH)3胶体制备
反应方程式:
FeCl3+3H2O=Δ=Fe(OH)3+3HCl
关键词:煮沸,滴入,饱和,变色,停止
To Attention:
- 使用蒸馏水
- 一定用饱和溶液
- 不可搅拌
- 不可过度加热
胶体聚沉
- 加入酸碱盐溶液
- 加入带相反电荷的胶粒
- 加热促进其热运动
Fe(OH)3胶体净水
附着污物聚沉达到净水效果,无明显氧化还原性,无法用于消毒
单质不涉及电解质
电解质与非电解质就化合物而言,单质无从论起电解质与非电解质。
电解质定义
在水溶液里或熔融状态能导电的化合物。
To Attention:
- 水溶液必须是溶解的自身离子导电,SO2溶于水,生成H2SO3,导电,并非SO2导电,故其不是电解质
- 熔融状态下的HCl不导电!但水溶液导电,所以是电解质
离子方程式的根本目的
找到反应本质,舍弃细枝末节,进而总结普适性反应规律。
H++OH-==H2O
该离子方程式仅适用于:强酸与强碱反应生成可溶性盐和水
不适用例:
Ba(OH)2+H2SO4==BaSO4↓+2H2O
氧化与还原
被氧化:被抢电子,价上升
被还原:电子被还回来,价下降
体现氧化性、体现还原性、体现酸性、体现碱性
体现氧化性:在反应中作氧化剂
体现还原性:在反应中作还原剂
体现酸性:在反应中电离出氢离子并与其他物质结合形成纯净物。
体现碱性:在反应中电离出羟基并与其他物质结合形成纯净物。
强弱律
氧化性:氧化剂 > 氧化产物
还原性:还原剂 > 还原产物
优先律
总结:强强联合
常用金属/非金属的氧化/还原性比较:
金属离子氧化性(还原性相反):
K+ < Ca2+ < Na+ < Mg2+ < Al3+ < Zn2+ < Fe2+ < Pb2+ < H+ < Cu2+ < Fe3+ < Ag+
单质顺序相同,但主要显还原性,
非金属离子还原性(氧化性相反):
F- < Cl- < Br- < I- < S2-
单质顺序相同,但主要显氧化性。
少量,过量问题
- 弱酸盐与强酸反应,酸多正盐,酸少酸式盐
- 弱酸与强碱反应,酸少正盐,酸多酸式盐
- 酸式盐与碱反应,以少定多,假定少量物质化学计量数为1
方程式积累:
CO2+Ca(OH)2==CaCO3+H2O
2CO2+Ca(OH)2==Ca(HCO3)2
Na2CO3+HCl==NaHCO3+NaCl
Na2CO3+2HCl==H2O+CO2+2NaCl